Опухоли позвоночника лучевая диагностика
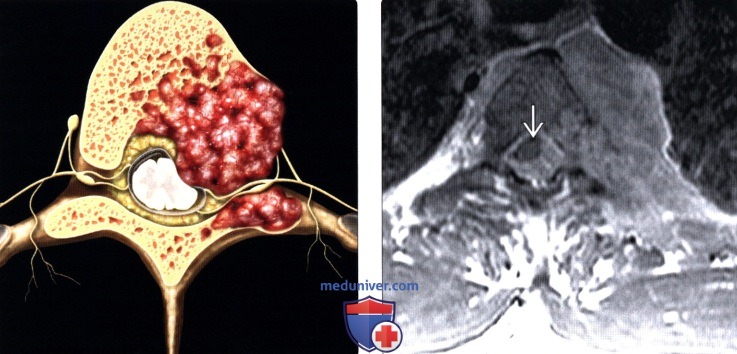
Лучевая диагностика опухоли позвоночникаа) Вопросы лучевой диагностики с позиций анатомии. Новообразования, поражающие позвоночник, могут распространяться напрямую, по лимфатическим путям, гематогенным путем и стоком ликвора. Может также наблюдаться сочетание различных путей распространения опухоли, при этом наиболее типичным является гематогенная диссеминация опухоли в тела позвонков с последующим прямым проникновением ее в эпидуральное пространство. Первичные опухоли паравертебральных мягких тканей также могут поражать позвоночный столб. Примером служит рак легких, прорастающий в грудную стенку, паравертебральные ткани и далее в позвоночник и эпидуральное пространство. Опухоли предстательной железы, мочевого пузыря или кишечника могут прорастать в пресакральное пространство и затем в позвоночник и эпидуральное пространство. Рак носоглотки может распространяться в область ската и основания черепа и далее следовать вдоль черепных нервов. В редких случаях может наблюдаться прямой рост опухоли ЦНС вдоль биопсийного тракта или операционной раны. Также описаны редкие случаи роста опухоли ЦНС вдоль постоянного шунтирующего катетера с последующим системным метастазированием. Данные лучевой диагностики в случае прямого распространения опухоли и поражения позвоночника включают мягкотканное объемное образование с разрушением соседних костных структур и различной выраженности сдавлением нервных образований. Напрямую в эпидуральное пространство наиболее часто распространяются опухоли из тел позвонков, разрушающие заднюю продольную связку. Передняя продольная связка и межпозвонковый диск относительно резистентны к опухолевой инвазии. Передняя продольная связка более мощная по сравнению с задней и характеризуется меньшим числом перфорирующих ее сосудов. При проникновении в эпидуральное пространство опухоль встречается с достаточно толстой твердой мозговой оболочкой, которая является эффективным барьером для дальнейшего распространения опухоли. Описанные барьеры позволяют на основании лучевых признаков достаточно четко разграничить инфекционное поражение диска с вовлечением смежных участков позвонков, при котором эпицентром является именно межпозвонковый диск, и опухолевое поражение, когда эпицентром являются тела позвонков, а межпозвонковые диски остаются относительно сохранными. Прямое распространение опухоли также может наблюдаться при первичных опухолях спинного мозга на шейном уровне, когда опухоль растет в инфратенториальное пространство. Изредка до верхнешейного уровня могут распространяться опухоли ствола мозга или мозжечка. Лимфогенный путь распространения опухолей в лучевой диагностике поражений позвоночника имеет лишь ограниченное значение. Местно-распространенный рост опухолей таза с инвазией поясничного отдела позвоночника при отсутствии метастазов в легких позволяет предположить распространение опухоли по венозным или лимфатическим коллекторам. Гематогенный путь является наиболее актуальным путем метастазирования злокачественных опухолей в позвоночник. Сплетение Батсона представляет собой продольно ориентированную сеть бесклапанных вен, расположенных вдоль позвоночного столба. Эти вены лежат вне плевральной и брюшной полости и имеют множество анастомозов с другими отделами венозной системы – полой веной, позвоночными венами, воротной веной, межреберными венами, легочными и почечными венами. Направление кровотока в сплетении Батсона вариабельно и зависит от внутригрудного и внутрибрюшного давления. Опухоли самой различной анатомической локализации могут метастазировать по венам этого сплетения, минуя легкие или печень. Клетки рака простаты вместе с током крови по венам сплетения Батсона могут метастазировать в тела позвонков, минуя нижнюю полую вену. Рак молочной железы распространяется в тела позвонков через систему непарной вены и сплетение Батсона. В сплетение Батсона шунтируется не более 5-10% объема портального кровотока, что объясняет относительно невысокую частоту спинальных метастазов при первичных опухолях желудочно-кишечного тракта и мочеполовой системы. При подавляющем большинстве метастатических поражений позвоночника точно сказать, каким путем произошло метастазирование, невозможно. Органотропные характеристики опухолевых клеток и особенности зоны их имплантации могут иметь даже более важное значение, чем тот или иной путь их метастазирования. Распространение по ликворопроводящим путям является важным путем метастазирования первичных интракраниальных опухолей. Опухолевые эмболы попадают в ликвор при фрагментации опухоли, а также при тех или иных хирургических манипуляциях. Распространение по ликворопроводящим путям описано для таких опухолей ЦНС, как медуллобластома, эпендимома, опухоли шишковидной железы, астроцитома и лейкемия, карцинома сосудистого сплетения и ретинобластома (неблагоприятный прогноз при амплификации гена MYCN). Метастазирование по ликворопроводящим путям может наблюдаться и после первичной гематогенной диссеминации опухоли. Например, подобная картина будет иметь место при метастатическом поражении спинного мозга и мягких мозговых оболочек после первичного гематогенного поражения позвоночника при раке легких и молочной железы.
б) Вопросы патологической анатомии. Метастатическое поражение внутренних органов и костей скелета развивается у 40% больных раком. Позвоночник является наиболее типичным местом костного метастазирования. Метастатическое поражение позвонков несколько чаще наблюдается у мужчин (соотношение мужчин и женщин составляет 3:2). Большинство метастатических поражений тел позвонков составляют метастазы рака предстательной железы, легких и молочной железы. Локализация— грудной отдел (70%) > поясничный отдел (20%) > шейный отдел. Первичные опухоли обычно образованы различными в биологическом отношении клетками, отличающимися различным метастатическим потенциалом. Клетки опухолей постоянно попадают в общий кровоток, но сохраняют жизнеспособность и достигают отдаленных органов-мишеней менее 0,01-0,1 % из них. Процесс метастазирования достаточно сложен и включает несколько этапов: отделение клетки от первичной опухоли, попадание в кровоток, ликвор или лимфатическую систему, сохранение жизнеспособности в транспортной системе, прикрепление к эндотелию сосудов отдаленных от первичного источника органов и тканей, а также выход из сосуда в интерстициальное пространство и, наконец, формирование локального кровоснабжения в зоне имплантации. Отдаленные от первичного источника органы и ткани отличаются своими анатомическими особенностями. Это касается в т.ч. и характера венозного и артериального кровоснабжения. в) Механизмы туморогенеза. Туморогенез у человека является многоэтапным процессом. Его этапы являются отражением генетических нарушений, которые индуцируют прогрессирующую трансформацию нормальных клеток человеческого тела в высокозлокачественные их формы. Показано, что заболеваемость раком имеет четкую возрастную зависимость и связана с развитием 4-7 ограниченных во времени случайных событий. Развитие опухоли требует наличия определенных изменений генома клетки, каждое из которых характеризуется теми или иными изменениями роста и деления клеток, что в конечном итоге приводит к прогрессирующей трансформации нормальных клеток в опухолевые. Раковые клетки по определению характеризуются дефектами регуляторных механизмов, которые в норме отвечают за пролиферацию клеток и их гомеостаз. Дефекты эти подразделяют на шесть типов: Каждое из этих шести изменений физиологии клетки является отражением нарушения механизмов противораковой защиты, присущих всем клеткам и тканям человеческого тела. Нормальные клетки человеческого тела начинают активно пролиферировать только при получении соответствующих сигналов. Эти сигналы передаются клеткам через трансмембранные рецепторы, которые способны связываться с самыми различными сигнальными молекулами – диффундирующие факторы роста, компоненты внеклеточного матрикса и клеточные адгезивные молекулы (КАМ). Многие опухолевые клетки приобретают способность самостоятельно синтезировать необходимые им факторы роста, что формирует патологический замкнутый круг. Примерами являются продуцирование клетками глиобластомы тромбоцитарного фактора роста (TDGF) или клетками сарком фактора роста опухолей α (TGF-α). В опухолях мозга обнаруживается рецептор к эпидермальному фактору роста (EFR-R). Нормальные ткани обладают различными механизмами, ограничивающими их пролиферацию. Это и ингибиторы факторов роста, и ингибиторы в составе внеклеточного матрикса на поверхности соседних клеток. Многие антипролиферативные факторы проникают в клетку через каналы, образованные различными вариантами белка, называемого супрессором роста ретинобластомы (pRb). Нарушение этого пути делает клетки нечувствительными к антипролиферативным факторам за счет репрессии факторов транскрипции, кодируемых геном E2F, и пролиферации клеток. Обход механизма запрограммированной гибели клетки (апоптоза) обычно развивается за счет мутаций гена-супрессора опухолей р53. Инактивация белка, кодируемого этим геном, наблюдается более чем у 50% больных злокачественными опухолями. Неограниченный репликативный потенциал злокачественных клеток выражается в их «бессмертии». Нормальные клетки человека делятся не более 60-70 раз. Этот процесс, по-видимому, связан с концевыми участками хромосом, называемыми теломерами. В процессе многочисленных циклов деления эти участки хромосом повреждаются, утрачивая способность защищать от повреждения хромосомную ДНК. Постепенно это приводит к критическому повреждению и гибели клетки. Во всех типах злокачественных клеток теломеры хромосом оказываются неповрежденными. В раковых клетках теломеры сохраняют длину выше некоторого порогового значения, что дает клетке возможность неограниченной пролиферации. Одним из наиболее изученных аспектов патофизиологии опухолевых клеток является, наверное, ангиогенез опухолей. В качестве классических индукторов ангиогенеза рассматриваются сосудистый эндотелиальный фактор роста (VEGF) и фактор роста фибробластов (FGF). Всего известно более двух дюжин ангиогенез-индуцирующих факторов и такое же количество их ингибиторов.
г) Метастазирование и движение клеток. Метастазы являются причиной 90% смертей от онкологических заболеваний. Инвазивный рост опухоли и метастазирование являются очень сложными процессами, в которых задействовано множество генетических и биохимических механизмов. Эти процессы можно описать такими терминами, как инвазия опухоли, гематогенная или лимфогенная диссеминация опухолевых клеток, колонизация отдаленных органов и развитие метастаза. В удержании клеток в присущем для них микроокружении участвует несколько классов белков. При инвазии и метастазировании эти механизмы меняются. Межклеточная регуляторная сигнальная система построена на КАМ и интегринах. Первым барьером на пути опухолевых клеток является базальная мембрана. Рецепторы на поверхности клеток распознают гликопротеины базальной мембраны, к которой прикрепляются клетки. За этим следует протеолиз входящего в состав базальной мембраны коллагена IV типа опухолеспецифичными коллагеназами. Происходит лизис базальной мембраны и клетки получают доступ в интерстициальное пространство, лимфатические и кровеносные сосуды. Хемоаттрактанты путем активации специфических рецепторов и нисходящих внутриклеточных сигнальных путей могут активировать процесс миграции и инвазии клеток. Этот процесс коренным образом реорганизует актиновый цитоскелет клеток. Хорошо известными регуляторами организации цитоскелета являются Rho/Rac ГТФ-азы. Активация Rac приводит к формированию складок клеточных мембран, образованию адгезивных комплексов и развитию у клеток ламеллоподий. Диссеминация и движение опухолевых клеток осуществляется тремя различными путями, включающими эпителиально-мезенхимальное перемещение (ЭМП), амебообразное движение и коллективную миграцию. При ЭМП клетка удлиняется, ферментативно разрушает расположенный вокруг себя матрикс и мигрирует, образуя на своей поверхности выросты, подобные псевдоподиям. При амебообразном движении клетка приобретает сферическую форму и проходит по пространствам во внеклеточном матриксе. При коллективной миграции клетки мигрируют целыми пластами или кластерами. ЭМП включает уменьшение числа эпителиальных маркеров в области плотных межклеточных контактов и цитокератиновой филаментной сети и увеличение числа мезенхимальных маркеров — N-кадерина, виментина, интегринов, тенасцина С, фибронектина и фибробласт-специфичного протеина 1. N-кадерин, по-видимому, является наиболее важным из этой группы маркеров. Процессы ЭМП управляются внутриклеточными онкогенными факторами, например, мутацией K-Ras или гиперэкспрессией гена Нег2. При некоторых опухолях, например, раке легкого, роль центрального регулятора ЭМП принадлежит TGFβ. TGFP индуцирует процессы ЭМП путем влияния на гены, участвующие в процессах пролиферации клеток, апоптоза, дифференцировки, движения и миграции.
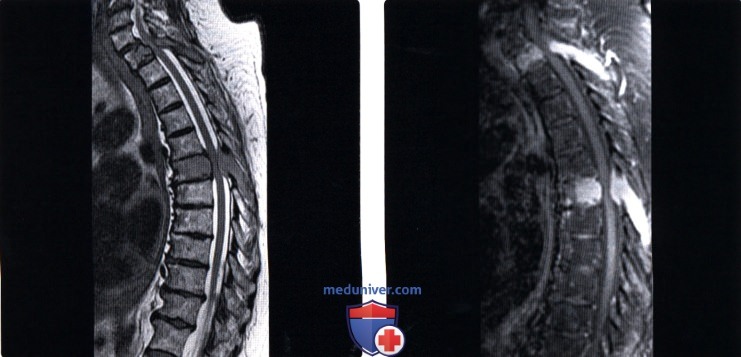
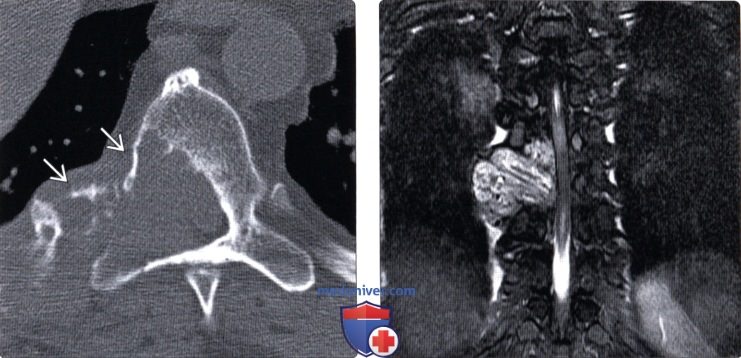
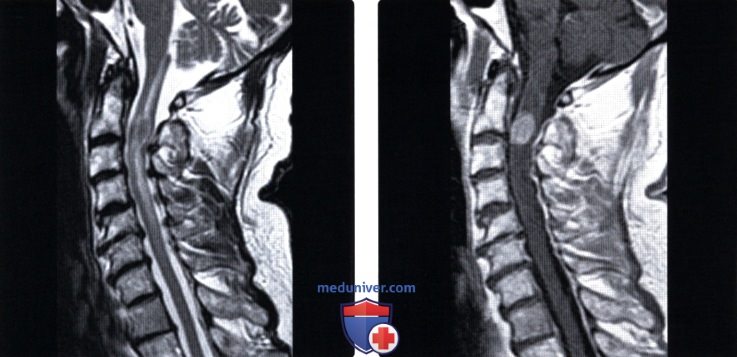
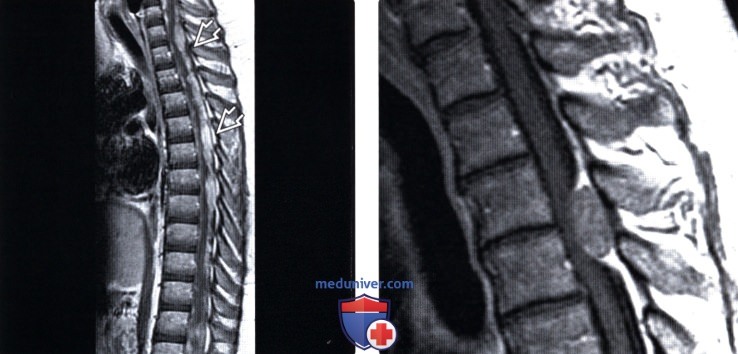
д) Клинические вопросы. Основным проявлением метастатического поражения позвоночника является постоянная боль в спине. При объективном исследовании чаще всего ничего не обнаруживается, либо обнаруживается только на поздней стадии заболевания (пальпируемое объемное образование или деформация позвоночника). Боль в спине и слабость нижних конечностей являются признаками эпидурального распространения опухолевого процесса. Ввиду наличия перекреста спиноталамических трактов уровень нарушения чувствительности может определяться на 1-2 сегмента ниже уровня компрессии. Чувствительные нарушения являются редким проявлением метастатического поражения позвоночника. е) Список использованной литературы: – Также рекомендуем “Рентгенограмма, сцинтиграмма, КТ, МРТ бластических костных метастазов позвоночника” Редактор: Искандер Милевски. Дата публикации: 22.8.2019 |
Источник