Нервные стимуляции на позвоночник
Нейростимуляция спинного мозга – методика лечения хронического болевого синдрома, вызванного различными заболеваниями. Электрические пульсирующие сигналы издаются из специальных электродов, которые имплантируют в эпидуральный отдел, и генератора, введенного чрескожно в нижнюю брюшную область или ягодицы.
Показания и противопоказания
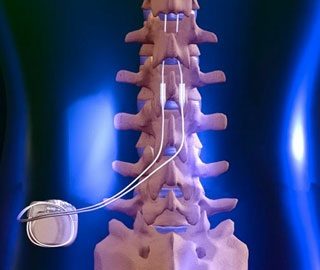
Стимуляцию нервов проводят для снятия болей при лечении патологий позвоночника
Трансвертебральная микрополяризация спинного мозга улучшает общее состояние и устраняет боль в период лечения следующих заболеваний спинного мозга и нервов:
- синдрома неудачно прооперированного позвоночника: операция на спинной мозг может вызвать состояние, характеризующееся персистирующими или рецидивирующими радикулярными синдромами – болью, онемением, слабостью мышц и др.;
- радикулита спинного отдела с болевым синдромом или без него;
- диабетической невропатии;
- постгерпетической невралгии;
- поражения периферического нерва с развитием невропатического болевого синдрома;
- рефрактерной стенокардии;
- болезни Рейно, облитерирующего эндартериита – сосудистых заболеваний нижних и верхних конечностей;
- стеноза позвоночного канала.
Трансвертебральный нейростимулятор встраивают после травмы спинного мозга или позвоночника (сильного ушиба и др.). Также метод эффективен в лечении спастической боли при нарушении работы органов таза, последствий инфаркта нейрогенного характера. Нейротехнологию используют после операции по удалению опухоли на спине (в спинном мозге, ином отделе).
Несмотря на эффективность способа, делать нейромодуляцию запрещено при наличии следующих противопоказаний:
- развитие тяжелого соматического заболевания;
- инкурабельная лекарственная зависимость;
- развитие психического заболевания, наличие суицидальных попыток в анамнезе;
- снижение интеллектуальных способностей у больного, задержка психического развития (ЗПР), например, при ДЦП, что выступает препятствием к применению системы электростимулирования;
- наличие активной инфекции в области, где планируется операция и работа электростимулятора.
Если делать такое хирургическое вмешательство вопреки противопоказаниям, можно вызвать негативные последствия, среди которых инфицирование спинного мозга, неэффективность вмешательства: отсутствие стимуляции или ее прерывистость, изменение области боли после операции и др.
Механизм работы

Пораженный участок плохо проводит нервные импульсы — аппарат доносит их до центров головного мозга
С болевыми ощущениями сталкивался каждый человек хоть раз в жизни. Нередко они локализуются в зоне спины. Если не лечить провоцирующее заболевание, симптом приобретает хроническое течение, сказываясь на психологическом, эмоциональном и физическом состоянии.
Не все спешат обращаться к врачу при наличии постоянных болей, боясь, что полноценное лечение не поможет избавиться от дискомфорта. Для снижения интенсивности боли в современной медицине имеется множество способов, например, медикаментозные с использованием сильных анальгетиков. Некоторые психические и нервные заболевания лечат методом вербальной терапии – электростимуляцией.
Как работает имплантация временных электродов для нейростимуляции спинного мозга, до сегодняшнего дня выяснено не до конца. Установлено, что при невропатических болях стимулирование спинного мозга способствует локальным нейрохимическим изменениям в отростках, что вызывает подавление гиперэксцибильности нейронов.
Соответствующими исследованиями доказана возможность высвобождения серотонина при стимуляции и подавление активности раздражающих аминокислот – аспартата и глютамина. При ишемической боли в ногах и руках анальгетический эффект обусловлен восстановлением нормального процесса обеспечения клеток кислородом. В результате снижается тонус сосудов, расширяется их просвет, устраняется спазм.
Нейропатический стимулятор оснащен следующей системой:
- импульсным генератором;
- пультом управления;
- электродами;
- соединительными проводами.
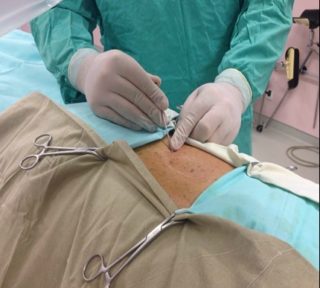
Устройство вводят под местным наркозом через небольшой разрез
Генератор имплантируют чрескожно. Механизм действия имеет сходства с приемником радиочастот, который управляется из внешнего модуля. Это имплантируемый импульсный генератор, зарядка которого происходит с помощью батареи бесконтактно. Не требуется хирургическое вмешательство для замены батарейки.
Пульт предназначен для управления приемником радиочастот (включения и выключения). В нем присутствует легко заменяемая батарея.
Электроды – металлические пластины с общим выводом (катетером или сужающейся пластиной в форме весла). Микрополяризация может осуществляться с помощью биполярных и мультиполярных электродов.
Перкутанные электроды (с выходом в виде катетера) имплантируют под местной анестезией, используя седативные препараты в минимальном объеме. Это способствует оптимизации процесса внедрения стимулятора и снижению риска нейротравмы.
Весловидные электроды встраиваются в области спинного мозга через хирургический разрез с последующей ламинотомией или ламинэктомией. Используется общий наркоз во время операции.
Разновидности электростимуляции
Восстановление организма пациента в период реабилитации методом электростимуляции проводят несколькими способами:
- функциональной электростимуляцией;
- эпидуральной стимуляцией;
- интраспинальной микростимуляцией.
Механизм действия функциональной электростимуляции связан с использованием курсов влияния электрическими токами, что позволяет вызвать мышечные сокращения и движения, необходимые для выполнения конкретных задач. Активизация мышц происходит вследствие стимуляции двигательных точек.
Функциональная электростимуляция – наиболее распространенный метод лечения последствий позвоночно-спинномозговой травмы. Чаще используют накожный способ расположения электродов, в связи с чем стимуляцию называю неинвазивной.

Более сложное оборудование способно научить парализованного ниже поясницы человека ходить и стоять
Если наблюдается нижняя параплегия (паралич обеих ног), требуется использование многоканальных устройств, предназначенных для восстановления шаговых движений и тренировки стояния. Накожные электроды стимулируют малоберцовый нерв, четырехглавую мышцу бедра, ягодичные мышцы.
Микрокомпьютер обеспечивает отхождение стимулирующих импульсов в данные отделы, что создает условия для выполнения разгибания ног, удержания в одном положении, сгибания и разгибания голеностопных суставов при инициации ходьбы.
Методика эпидуральной электростимуляции спинного мозга заключается в воздействии на корешки специальными электродами. Генератор имплантируют чрескожно в нижний брюшной отдел или ягодицы. Управление происходит с помощью пульта.
Если сравнивать эпидуральный метод с функциональным, последний предполагает временное применение, то есть курсами, а первый – долговременное использование. Действие эпидуральной стимуляции направлено на снижение спастичности, появление двигательных реакций в конечностях.
Интраспинальная микростимуляция обеспечивается за счет встраивания микроэлектродов в спинной мозг. Клинические случаи инвазивной стимуляции у людей на сегодняшний день не зарегистрированы. Метод применяем пока только на животных.
Доверить хирургическое вмешательство по встраиванию электростимулятора спинного мозга нужно квалифицированному врачу, который владеет соответствующими навыками. От этого зависит исход операции и риск негативных последствий.
Источник
«Это потрясающее чувство. Я вновь могу согнуть колени, самостоятельно поднять ноги и даже пошевелить пальцами», — рассказывает один из участников экспериментального лечения, которому удалось вернуть свои двигательные способности за счет технологии спинномозговой стимуляции. После травмы позвоночника, полученной 2010 году, его ноги были парализованы.
Фактически сразу несколько исследовательских групп как в России, так и за рубежом трудятся над различными способами лечения паралича, вызванного инсультом или травмой спинного мозга. Благодаря инновационным протоколам лечения пациенты с хронической параплегией заново учатся ходить.
Подобные технологии позволяют стимулировать спинной мозг сверхточными электрическими импульсами, активировать нейромышечные связи ниже травмы и одновременно с этим усиливать остаточные команды от мозга.
Какие механизмы реабилитации уже существуют и могут быть использованы для лечения?
Травма спинного мозга приводит к серьезным нарушениям двигательной активности, значительно снижает качество жизни и влечет за собой значительные расходы для семей и общества. Чтобы преодолеть последствия подобных недугов, ученые стараются восстановить у парализованных людей именно способность ходить.
По мнению нейрофизиологов решающее значение для реабилитации двигательных функций имеет временное совпадение между внешней электостимуляцией и остаточной командой мозга. Так, чтобы добиться идеальной синхронизации, швейцарские ученые из Федеральной политехнической школы Лозанны (EPFL) связали расшифровку двигательного намерения мозга с подачей электросигналов для стимуляции спинного мозга через имплант.
В России подобными исследованиями занимается команда Юрия Герасименко, который много лет возглавляет Институт физиологии им. И.П. Павлова в Санкт-Петербурге. Совместно с российскими и американскими коллегами ему удалось сломать главный стереотип о параличе нижних конечностей.
Ещё лет двадцать назад считалось, что повреждения позвоночника носят анатомический характер, а движениями ног напрямую управляет головной мозг. Ученые расценивали позвоночник исключительно как проводником между мозгом и нижними конечностями и если под воздействием травмы эта связь нарушалась, то человек был вынужден навсегда пересесть в инвалидное кресло.
Но это оказалось заблуждением.
В Институте физиологии после долгих лет упорной работы сумели доказать, что учёные прошлых лет недооценивали значимость спинного мозга, и за движения нижних конечностей человека, в частности, способность ходить, отвечает именно спинной мозг.
Спинной мозг – орган центральной нервной системы, нервная трубка, находящаяся в позвоночном канале. Она делится на 31 сегмент, каждый из которых управляет своей частью тела и собирает информацию – болевую, кожную и мышечную.
Спинной мозг обладает всеми механизмами для инициации и регуляции движений. А это значит, что «починить» человека при параличе можно воздействуя именно на этот орган. Задачей ученых, работающих в Институте физиологии, было научиться управлять шагами, стимулируя спинной мозг. Нейрофизиологи проводили тестирование различных участков спинного мозга у животных в продольном и горизонтальном направлении, пока, наконец, не нашли зону, стимуляция которой вызывала шагательные движения.
«У человека, как у любого млекопитающего в спинном мозгу существуют участки, ответственные за ходьбу. В Хьюстоне поставили задачу – применить к пациентам с травмой спинного мозга стимуляцию, чтобы инициировать шагательные движения. И мы описали у всех пациентов зону, стимуляция которой вызывает необходимую реакцию», – рассказывает Юрий Герасименко.
В ходе дальнейшей работы учёным удалось доказать, что поражение спинного мозга, возникающее при травме позвоночника, носит не анатомический характер, а функциональный. Следовательно, воздействуя на определенные центры, можно восстановить функцию, нарушенную травмой.
Команда Юрия Герасименко разработала такую методику воздействия на спинной мозга, в ходе которой на оболочку нервной трубки устанавливаются электроды, а под брюшину имплантируется стимулятор. Вследствие электростимуляции нервные клетки, взаимодействуя с проводящим имплантом, создают связанные цепочки в обход повреждённого участка и организм «ремонтирует» систему связи между головным и спинным мозгом.
По итогам такого лечения пациент восстанавливается от полного паралича до возможности самостоятельно ходить своими ногами. Стимулятор подает электрические импульсы, которые запускают парализованные ноги и одновременно с этим сигналы «эхом» уходят в головной мозг. И понемногу, шаг за шагом, человек заново учится управлять телом.
«Я даже сидеть стал намного лучше, потому что окреп позвоночник. Я стреляю из лука, хожу по беговой дорожке. Да, мне пока нужны ходунки, и за мной присматривает тренер, но я уверен, что скоро не буду нуждаться в помощи. Это главное для меня», – рассказал один из пациентов доктора Герасименко.
В тоже время, европейские ученые смогли далеко продвинуться в вопросе эффективности и скорости лечения. Если раньше пациенты демонстрировали прогресс только спустя несколько месяцев интенсивной реабилитации, чаще всего — примерно через год. То исследование, выполненное в Швейцарии, показало, как пациенты смогли вновь ходить (с небольшой помощью) спустя всего несколько дней. А после нескольких месяцев тренировок контролировать ранее парализованные мышцы ног даже при отсутствии электростимуляции.
Разница подходов заключалась в том, насколько постоянным был внешний источник тока. Для эпидуральной электростимуляции, как в других исследованиях, пациенту было имплантировано устройство, которое доставляет электрические сигналы в позвоночный столб ниже области повреждений. Когда травма нарушает связь между спинным и головным мозгом, не давая нервным сигналам достигать конечностей, электростимулятор выступает в роли «моста», перенося электрические сигналы в области позвоночника под местом травмы.
Чтобы понять, как нервная система подает электрические сигналы, чтобы обеспечить каждое движение конечностей, исследователи создали «карту» того, как выглядят типичные импульсы мозга, направленные на активацию движений. Затем они определили, в какую область позвоночника электроды должны доставлять стимулирующие сигналы, чтобы соответствовать обнаруженным паттернам и построили систему, которая передавала сигналы ровно туда, куда нужно.
Ученым пришлось подбирать отдельные параметры системы под каждого пациента. Они даже создали персонализированные модели позвоночников, находящиеся в солевом растворе, проводящем электрический ток, что позволило команде в точности определить, куда поместить электроды при последующей операции. Затем паттерны электрических сигналов были откалиброваны под каждого пациента.
«Все подопытные смогли ходить с использованием ассистивных устройств спустя неделю», — подтвердила одна из руководителей группы ученых Джоселин Блотч. В последующих тестах пациенты оказались способны произвольно выбирать длину и скорость своих шагов и в течении часа идти по беговой дорожке, проходя дистанцию порядка одного километра. Все движения самостоятельно выбирались человеком, а эпидуральный имплант при этом не генерировал никаких непроизвольных движений.
«Наши пациенты должны были постоянно думать о совершении подходящих движений ног. Их мозг оставался активным все время, чтобы отрабатывать сигналы цепи обратной связи с электростимуляцией, которая активировала мышцы», — сказала Карен Минассиан, одна из авторов работы. Из-за постоянной вовлеченности, лечение привело к тому, что произвольные движения со временем восстанавливались по мере того, как вновь появлялись соединения в нервной системе.
Успешность лечения зависит от ряда факторов, включая тяжесть травмы и уровень оставшихся двигательных функций. Для некоторых, оно может привести к масштабным улучшениям за короткое время. По мнению ученых, проверка методики на большем числе подопытных станет важным следующим шагом. Ученые планируют изучить результаты методики на людях, получивших свои травмы недавно, когда «потенциал пластичности находится на максимальном уровне, а нейромышечная система еще не испытала эффекта атрофии вследствие хронического паралича».
Ученые отмечают, что данная техника пока еще не готова для применения в клинических условиях. Необходимо тщательно проверить все аспекты подобного лечения, в том числе его эффект на повседневную жизнь пациента за пределами госпиталя. Исследователи разработали активируемую голосом систему, которая позволяет пациенту включать и выключать эпидуральную электростимуляцию по желанию, а также выбирать один из нескольких режимов стимуляции: ходьба, езда на трицикле и т.д. Заставить имплант работать — это важная задача, но также необходимо сделать его доступной использования пациентом в повседневных условиях.
Уже сейчас российские учёные создали следующее поколение подобного устройства – беспроводной стимулятор. Эти открытия и разработки лягут в основу новых интернациональных проектов, которые построят будущее медицинской реабилитации. Будущее, в котором людям не понадобятся инвалидные коляски.
Источник
ÐоÑÑеÑÐºÐ°Ñ ÐÑÐµÐ½Ð¸Ñ ÐндÑеевна ÑпеÑиалиÑÑ Ð¾Ñдела «ÐейÑо», ÐºÐ¾Ð¼Ð¿Ð°Ð½Ð¸Ñ ÐÐÐÐÐÐТР(St. Jude Medical)
РпÑакÑике Ð¼Ð½Ð¾Ð³Ð¸Ñ ÑпиналÑнÑÑ Ñ Ð¸ÑÑÑгов неÑедки ÑлÑÑаи, когда паÑиенÑÑ Ð¿ÑÐ¾Ð²ÐµÐ´ÐµÐ½Ñ Ð½ÐµÐ¾Ð´Ð½Ð¾ÐºÑаÑнÑе опеÑаÑивнÑе вмеÑаÑелÑÑÑва: микÑодиÑкÑкÑомиÑ, ÑадикÑлолиз, ÑаÑеÑÑкÑомиÑ, а боли, ÑÑойкие и ÑпоÑнÑе, пÑодолжаÑÑ Ð¼ÑÑиÑÑ ÐµÐ³Ð¾, ÑÑ ÑдÑÐ°Ñ ÐºÐ°ÑеÑÑво жизни, заÑÑавлÑÑÑ Ñеловека ÑÑвÑÑвоваÑÑ ÑÐµÐ±Ñ Ð±ÐµÑпомоÑнÑм в обÑеÑÑве.
Ðе ÑмоÑÑÑ Ð½Ð° бÑÑÑÑое ÑазвиÑие ÑовÑеменного Ñ Ð¸ÑÑÑгиÑеÑкого обоÑÑдованиÑ, по даннÑм ÑÑаÑиÑÑики, нейÑÐ¾Ð³ÐµÐ½Ð½Ð°Ñ Ð±Ð¾Ð»Ñ Ð¿Ð¾Ñле опеÑаÑивного вмеÑаÑелÑÑÑва ÑазвиваеÑÑÑ Ð² 20â40% ÑлÑÑаев. Такой ÑиндÑом назÑваÑÑ Â«Ð¡Ð¸Ð½Ð´Ñом ÐпеÑиÑованного ÐозвоноÑника» или FBSS (Failed Back Surgery Syndrome).
ÐÑли опиÑаÑÑÑÑ Ð½Ð° английÑкое название ÑиндÑома, можно подÑмаÑÑ, ÑÑо ÑÑи боли â ÑезÑлÑÑÐ°Ñ Ð½ÐµÑдаÑной опеÑаÑии. ÐÑо ÑовÑем не Ñак: опеÑаÑии, как пÑавило, пÑÐ¾Ð²ÐµÐ´ÐµÐ½Ñ Ð±Ð»ÐµÑÑÑÑе: Ñ Ð¸ÑÑÑÐ³Ñ ÑдаÑÑÑÑ ÑÑабилизиÑоваÑÑ Ð¿Ð¾Ð·Ð²Ð¾Ð½ÐºÐ¸ или пÑовеÑÑи виÑÑÑозное Ñдаление гÑÑжи, но болÑ, нейÑÐ¾Ð³ÐµÐ½Ð½Ð°Ñ Ð±Ð¾Ð»Ñ, пÑоÑÑÑеливаÑÑаÑ, жгÑÑаÑ, наÑÐ¸Ð½Ð°ÐµÑ ÑазвиваÑÑÑÑ, неÑмоÑÑÑ Ð½Ð° оÑÑÑÑÑÑвие ÑизиологиÑеÑкой пÑиÑинÑ.
ÐеждÑнаÑÐ¾Ð´Ð½Ð°Ñ Ð°ÑÑоÑиаÑÐ¸Ñ Ð¿Ð¾ изÑÑÐµÐ½Ð¸Ñ Ð±Ð¾Ð»Ð¸ даÑÑ Ñакое опÑеделение FBSS: «ÐоÑÑниÑнÑе (или ÑейнÑе) боли неизвеÑÑного пÑоиÑÑ Ð¾Ð¶Ð´ÐµÐ½Ð¸Ñ Ð»Ð¸Ð±Ð¾ пеÑÑиÑÑиÑÑÑÑие боли, коÑоÑÑе ÑÐ¾Ñ ÑанÑÑÑÑÑ, неÑмоÑÑÑ Ð½Ð° пÑоведÑнное опеÑаÑивное вмеÑаÑелÑÑÑво, или возникаÑÑие поÑле данного вмеÑаÑелÑÑÑва в Ñой же Ñамой анаÑомиÑеÑкой облаÑÑи».
ÐаÑиенÑÑ, Ñ ÐºÐ¾ÑоÑÑÑ ÑазвиваеÑÑÑ Ð¡Ð¸Ð½Ð´Ñом ÐпеÑиÑованного позвоноÑника, как пÑавило, обÑаÑаÑÑÑÑ Ðº невÑологÑ, пÑÐ¾Ñ Ð¾Ð´ÑÑ ÐºÑÑÑ ÑаÑмакоÑеÑапии (неÑÑеÑоиднÑе пÑоÑивоÑпалиÑелÑнÑе пÑепаÑаÑÑ, миоÑелакÑанÑÑ, наÑкоÑиÑеÑкие аналÑгеÑики, анÑидепÑеÑÑанÑÑ) и/или полÑзÑÑÑÑÑ ÑизиоÑеÑапевÑиÑеÑкими аппаÑаÑами, ÑÑо ÑаÑÑо оказÑÐ²Ð°ÐµÑ Ð¿Ð¾Ð»Ð¾Ð¶Ð¸ÑелÑнÑй ÑÑÑекÑ. Ðо Ñо вÑеменем могÑÑ ÑазвиÑÑÑÑ Ð¼ÐµÐ´Ð¸ÐºÐ°Ð¼ÐµÐ½Ñозно-ÑезиÑÑенÑнÑе ÑоÑÐ¼Ñ Ð±Ð¾Ð»ÐµÐ²Ð¾Ð³Ð¾ ÑиндÑома. Ðо даннÑм амеÑиканÑкой ÑÑаÑиÑÑики, ежегодно наÑÑиÑÑваеÑÑÑ Ð´Ð¾ 50 ÑÑÑÑÑ ÑÐ°ÐºÐ¸Ñ ÑлÑÑаев.
Ðа ÑÑом ÑÑапе леÑÐµÐ½Ð¸Ñ Ñ Ð¿Ð°ÑиенÑа не оÑÑаÑÑÑÑ Ð±Ð¾Ð»ÑÑе дÑÑÐ³Ð¸Ñ Ð²Ð°ÑианÑов конÑÑÐ¾Ð»Ñ Ð±Ð¾Ð»Ð¸, кÑоме Ñ Ð¸ÑÑÑгиÑеÑÐºÐ¸Ñ . Ðдин из ÑпоÑобов ÑÑÑÑÐ°Ð½ÐµÐ½Ð¸Ñ Ð½ÐµÐ²Ñалгии â пÑеÑваÑÑ Ð¿ÐµÑедаÑÑ Ð±Ð¾Ð»ÐµÐ²ÑÑ Ñигналов. ÐапÑимеÑ, пÑовеÑÑи пÑоÑедÑÑÑ Ð½ÐµÐ²ÑоÑомии â ÐµÑ Ð´ÐµÐ»Ð°ÑÑ Ð½Ð° неÑвной Ñкани, ÑÑÐ¾Ð±Ñ Ð¿ÑедоÑвÑаÑиÑÑ Ð¿ÐµÑедаÑÑ Ð±Ð¾Ð»ÐµÐ²Ð¾Ð³Ð¾ Ñигнала. Ðо ÑÑо ÑиÑкованно, а Ñамое главное, Ð´Ð°Ð½Ð½Ð°Ñ Ð¿ÑоÑедÑÑа необÑаÑима.
Ð ÑезÑлÑÑаÑе, поÑле длиÑелÑного безÑÑпеÑного конÑеÑваÑивного и Ñ Ð¸ÑÑÑгиÑеÑкого леÑениÑ, ÑеÑез 3â6 меÑÑÑев паÑÐ¸ÐµÐ½Ñ Ñ FBSS Ð¼Ð¾Ð¶ÐµÑ ÑÑаÑÑ Ð¸Ð½Ð²Ð°Ð»Ð¸Ð´Ð¾Ð¼ пожизненно!
ÐдинÑÑвеннÑм обÑаÑимÑм меÑодом ÑпÑÐ°Ð²Ð»ÐµÐ½Ð¸Ñ Ñ ÑониÑеÑкой болÑÑ Ð½Ð° ÑегоднÑÑний Ð¼Ð¾Ð¼ÐµÐ½Ñ ÑвлÑеÑÑÑ Ð½ÐµÐ¹ÑомодÑлÑÑÐ¸Ñ (или нейÑоÑÑимÑлÑÑиÑ). ÐÑинÑип дейÑÑÐ²Ð¸Ñ â ÑÐ¾Ñ Ð¶Ðµ: пÑеÑекаеÑÑÑ Ð±Ð¾Ð»ÐµÐ²Ð¾Ð¹ Ñигнал, идÑÑий в головной мозг. Ðо! РоÑганизме не пÑоиÑÑ Ð¾Ð´ÑÑ Ð½ÐµÐ¾Ð±ÑаÑимÑе изменениÑ, ÑвÑзаннÑе Ñ Ð¾Ð¿ÐµÑаÑией. ÐÑÐ°Ñ (а поÑле и Ñам паÑиенÑ) пÑи помоÑи импланÑиÑованного ÑÑÑÑойÑÑва «закÑÑÐ²Ð°ÐµÑ Ð´Ð²ÐµÑÑ» пеÑед болÑÑ: паÑÐ¸ÐµÐ½Ñ Ð¿ÐµÑеÑÑаÑÑ Ð¾ÑÑÑаÑÑ Ð±Ð¾Ð»Ñ Ð² ÑвÑзи Ñ Ñем, ÑÑо Ñигнал не Ð¼Ð¾Ð¶ÐµÑ Ð¿ÑойÑи. Так как ÑÑÑÑанÑем Ð¼Ñ Ð¸Ð¼ÐµÐ½Ð½Ð¾ болÑ, а не маÑкиÑÑем воÑпалиÑелÑнÑй пÑоÑеÑÑ, Ñо ÑезÑлÑÑÐ°Ñ Ð´Ð¾ÑÑигнÑÑ: без побоÑнÑÑ Ð´ÐµÐ¹ÑÑвий (Ð½ÐµÑ Ñ Ð¸Ð¼Ð¸ÑеÑкого изменениÑ), вÑÑ Ð¾Ð±ÑаÑимо (вÑе клеÑки оÑганизма, вÑе нейÑÐ¾Ð½Ñ ÑелÑ, можно вÑклÑÑиÑÑ ÑÑимÑлÑÑÐ¸Ñ â и вÑÑ Ð²ÐµÑнÑÑÑÑ; ÑледоваÑелÑно, еÑли ÑеÑез 15, 20 Ð»ÐµÑ Ð±ÑÐ´ÐµÑ Ñоздана Ð½Ð¾Ð²Ð°Ñ ÑÐµÑ Ð½Ð¾Ð»Ð¾Ð³Ð¸Ñ, паÑÐ¸ÐµÐ½Ñ ÑÐ¼Ð¾Ð¶ÐµÑ ÐµÑ Ð¿Ð¾Ð¿ÑобоваÑÑ, Ñак как оÑÑÑÑÑÑвÑÑÑ Ð½ÐµÐ¾Ð±ÑаÑимÑе пÑоÑеÑÑÑ).
ÐÑинÑип дейÑÑÐ²Ð¸Ñ ÑÑимÑлÑÑии
ÐÐ¾Ð»Ñ â ÑÑо Ñигнал, коÑоÑÑй Ð¸Ð´ÐµÑ Ð¾Ñ Ð°Ð½Ð°ÑомиÑеÑкой Ð·Ð¾Ð½Ñ ÑеÑез Ñпинной мозг к головномÑ, а ÑÐ¾Ñ Ð²Ð¾ÑпÑÐ¸Ð½Ð¸Ð¼Ð°ÐµÑ ÐµÐ³Ð¾ как болевой. ЧÑÐ¾Ð±Ñ Ð¿ÑеÑваÑÑ ÑÑÐ¾Ñ Ñигнал до Ñого, как он Ð´Ð¾Ð¹Ð´ÐµÑ Ð´Ð¾ головного мозга, можно поÑлаÑÑ Ð´Ð¾Ð¿Ð¾Ð»Ð½Ð¸ÑелÑнÑй ÑлекÑÑиÑеÑкий импÑлÑÑ Ð¿ÑÑмо к ÑÐ¿Ð¸Ð½Ð½Ð¾Ð¼Ñ Ð¼Ð¾Ð·Ð³Ñ Ð¸Ð¼ÐµÐ½Ð½Ð¾ в Ñом меÑÑе, где неÑвнÑе оконÑÐ°Ð½Ð¸Ñ Ð±Ð¾Ð»Ñного оÑгана Ð²Ñ Ð¾Ð´ÑÑ Ð² него (болевой Ñигнал не ÑÐ¼Ð¾Ð¶ÐµÑ Ð¿ÑойÑи, и головной мозг не полÑÑÐ¸Ñ Ñигнал о боли). ÐÑинÑип дейÑÑÐ²Ð¸Ñ Ð¾Ñнован на ÑеоÑии РоналÑда ÐелÑзака (ÐеликобÑиÑаниÑ) и ÐаÑÑика Уолла (Ðанада), коÑоÑÐ°Ñ Ð±Ñла опÑбликована в 1965 Ð³Ð¾Ð´Ñ Ð² амеÑиканÑком жÑÑнале «Science». Ð ÑеÑез два года, опиÑаÑÑÑ Ð½Ð° ÑÑÑ ÑеоÑиÑ, амеÑиканÑкий Ñ Ð¸ÑÑÑг ÐоÑм Шили пÑÐ¾Ð²Ð¾Ð´Ð¸Ñ Ð¾Ð¿ÐµÑаÑÐ¸Ñ Ð¿Ð¾ ÑÑимÑлÑÑии Ñпинного мозга Ð´Ð»Ñ ÐºÐ¾Ð½ÑÑÐ¾Ð»Ñ Ð·Ð° болÑÑ Ñ Ð¿Ð°ÑиенÑа, ÑÑÑадаÑÑего Ñаком. ÐÑкоÑе ÑÑимÑлÑÑоÑÑ Ñпинного мозга наÑали акÑивно пÑименÑÑÑÑÑ Ð² пÑоÑивоболевой ÑеÑапии. СейÑÐ°Ñ Ð² миÑе ежегодно импланÑиÑÑеÑÑÑ Ð¾ÐºÐ¾Ð»Ð¾ 100 000 ÑиÑÑем, а к ÑледÑÑÑÐµÐ¼Ñ Ð´ÐµÑÑÑилеÑÐ¸Ñ (по пÑогнозам ÑпеÑиалиÑÑов) ÑÑа ÑиÑÑа возÑаÑÑÑÑ Ð´Ð¾ 240 000, за ÑÑÑÑ ÑвелиÑÐµÐ½Ð¸Ñ Ð±Ð¾Ð»ÑнÑÑ Ñ Ñ ÑониÑеÑкими заболеваниÑми, ÑаÑÑиÑÐµÐ½Ð¸Ñ Ð³ÐµÐ¾Ð³ÑаÑиÑеÑкого пÑÐ¸Ð¼ÐµÐ½ÐµÐ½Ð¸Ñ Ð´Ð°Ð½Ð½Ð¾Ð¹ ÑеÑапии.
СеÑÑиÑиÑиÑÐ¾Ð²Ð°Ð½Ð½Ð°Ñ Ð´Ð»Ñ ÑпÑÐ°Ð²Ð»ÐµÐ½Ð¸Ñ Ñ ÑониÑеÑкой болÑÑ Ð² Ñпине, Ñее, ÑÑÐºÐ°Ñ Ð¸ Ð½Ð¾Ð³Ð°Ñ Ð½ÐµÐ¹ÑоÑÑимÑлÑÑÐ¸Ñ ÑвлÑеÑÑÑ Ð¿ÑовеÑенной ÑеÑапией, коÑоÑÐ°Ñ Ñже более 40 Ð»ÐµÑ Ð¿ÑименÑеÑÑÑ Ð²ÑаÑами по вÑÐµÐ¼Ñ Ð¼Ð¸ÑÑ Ð´Ð»Ñ ÑлÑÑÑÐµÐ½Ð¸Ñ ÐºÐ°ÑеÑÑва жизни паÑиенÑа. РРоÑÑии нейÑоÑÑимÑлÑÑÐ¸Ñ Ð²Ñ Ð¾Ð´Ð¸Ñ Ð² квоÑÑ Ð¿Ð¾ нейÑÐ¾Ñ Ð¸ÑÑÑгиÑеÑÐºÐ¾Ð¼Ñ Ð²ÑÑокоÑÐµÑ Ð½Ð¾Ð»Ð¾Ð³Ð¸ÑÐ½Ð¾Ð¼Ñ Ð»ÐµÑениÑ.
ÐеÑвÑÑ Ð¾Ð¿ÐµÑаÑÐ¸Ñ Ð¿Ð¾ SCS (ÑÑимÑлÑÑÐ¸Ñ Ñпинного мозга) в СССРпÑовел в 1987 Ð³Ð¾Ð´Ñ Ð² ÐÐÐ ÐейÑÐ¾Ñ Ð¸ÑÑгии им. Ð. Ð. ÐÑÑденко нейÑÐ¾Ñ Ð¸ÑÑÑг, пÑоÑеÑÑÐ¾Ñ Ð. Ð. Шабалов. С 1991 года в РоÑÑии ÑÑали пÑименÑÑÑ Ð¾ÑеÑеÑÑвеннÑе модели «ÐейÑоÑлекÑ» (ÑазÑабоÑÑик â Ð. Ð. Шабалов ÑовмеÑÑно Ñ ÐÑеÑоÑÑийÑким наÑÑно-иÑÑледоваÑелÑÑким инÑÑиÑÑÑом опÑикоÑизиÑеÑÐºÐ¸Ñ Ð¸Ð·Ð¼ÐµÑений). Ð ÑожалениÑ, маÑеÑÐ¸Ð°Ð»Ñ Ð¸ каÑеÑÑво моделей не пÑиноÑили ÑÑабилÑнÑй долгоÑÑоÑнÑй ÑÑÑекÑ. ÐаÑÐ¸Ð½Ð°Ñ Ñ 1995 года, ÑÑали доÑÑÑÐ¿Ð½Ñ Ð°Ð¼ÐµÑиканÑкие импланÑиÑÑемÑе ÑиÑÑемÑ. Ðо вÑе Ñавно, ÑÑо бÑли лиÑÑ ÐµÐ´Ð¸Ð½Ð¸ÑÑ: вÑего 5â10 ÑÑÑк в год. Ð ÑолÑко Ñ 2001 года пÑи ÑинанÑиÑовании ÐиниÑÑеÑÑÑва ÐдÑÐ°Ð²Ð¾Ð¾Ñ ÑÐ°Ð½ÐµÐ½Ð¸Ñ Ð¸ Ðкадемии наÑк РФ колиÑеÑÑво ÑÐ°ÐºÐ¸Ñ Ð¾Ð¿ÐµÑаÑий и клиник (в коÑоÑÑÑ Ð¾Ð½Ð¸ пÑоводилиÑÑ) Ñезко возÑоÑло: Ñ 1 клиники в 2001 Ð³Ð¾Ð´Ñ Ð´Ð¾ 18 к наÑÑоÑÑÐµÐ¼Ñ Ð²Ñемени. ÐолиÑеÑÑво же импланÑиÑованнÑÑ ÑиÑÑем SCS в РоÑÑии к 2013 Ð³Ð¾Ð´Ñ Ð¿ÑевÑÑило 1000. СейÑÐ°Ñ ÑÑимÑлÑÑÐ¸Ñ Ñпинного мозга пÑоводиÑÑÑ Ð½Ð° ÑовÑеменнÑÑ Ð²ÑÑокоÑÐµÑ Ð½Ð¾Ð»Ð¾Ð³Ð¸ÑнÑÑ Ð°Ð¿Ð¿Ð°ÑаÑÐ°Ñ Ð¿Ð¾Ð²ÑемеÑÑно. Ðднако, нейÑоÑÑимÑлÑÑÐ¸Ñ â не излеÑение пÑиÑинÑ, вÑзÑваÑÑей болÑ, и не леÑение заболеваниÑ. Ðна ÑвлÑеÑÑÑ ÑеÑапией, коÑоÑÐ°Ñ Ñоздана Ð´Ð»Ñ Ð¼Ð°ÑкиÑовки боли (блокиÑÑÐµÑ Ð±Ð¾Ð»ÐµÐ²Ñе ÑÐ¸Ð³Ð½Ð°Ð»Ñ Ð´Ð¾ Ñого, как они доÑÑигнÑÑ Ð³Ð¾Ð»Ð¾Ð²Ð½Ð¾Ð³Ð¾ мозга). РоÑновном, нейÑоÑÑимÑлÑÑÐ¸Ñ Ð¿ÑименÑÑÑ Ð´Ð»Ñ ÑеÑапии СиндÑома ÐпеÑиÑованного ÐозвоноÑника (FBSS) или поÑÑ-ламинÑкÑомиÑеÑкого ÑиндÑома и дÑÑÐ³Ð¸Ñ Ð½ÐµÐ¹ÑопаÑий.
ÐейÑоÑÑимÑлÑÑÐ¸Ñ ÑÐ½Ð¸Ð¼Ð°ÐµÑ ÑолÑко нейÑопаÑиÑеÑкÑÑ Ð±Ð¾Ð»Ñ, дÑÑгие же Ð²Ð¸Ð´Ñ Ð±Ð¾Ð»Ð¸ (Ñакие, как зÑбнаÑ, киÑеÑнаÑ, пеÑиодиÑеÑкаÑ, оÑÑÑÐ°Ñ Ð¿Ñи ÑÑÐ°Ð²Ð¼Ð°Ñ Ð¸ пÑ.) оÑÑанÑÑÑÑ, ÑÑÐ¾Ð±Ñ Ð¾Ñганизм мог пÑавилÑно ÑпÑавлÑÑÑÑÑ Ñ Ð²Ð½ÐµÑними и внÑÑÑенними ÑакÑоÑами.

РиÑ. 1.ÐÑлÑÑ Ð¿Ð°ÑиенÑа (St. Jude Medical Inc.) – ÑÑÑÑойÑÑво, пÑи помоÑи коÑоÑого паÑÐ¸ÐµÐ½Ñ ÑегÑлиÑÑÐµÑ ÑÑимÑлÑÑÐ¸Ñ Ð² заданнÑÑ Ð²ÑаÑом пÑеделаÑ

РиÑ. 2. ÐенеÑаÑÐ¾Ñ Ð¸Ð¼Ð¿ÑлÑÑов. ÐмпланÑиÑÑеÑÑÑ Ð² подкожнÑй каÑман. СамÑй маленÑкий ÑÑимÑлÑÑÐ¾Ñ (Eonmini St. Jude Medical Inc.) â вÑего 10 мм в ÑолÑинÑ

РиÑ. 3. ÐлекÑÑÐ¾Ð´Ñ Ð´Ð»Ñ Ð¸Ð¼Ð¿Ð»Ð°Ð½ÑаÑии в ÑпидÑÑалÑное пÑоÑÑÑанÑÑво (St Jude Medical Inc.)
ÐпеÑаÑÐ¸Ñ Ð¿Ð¾ импланÑаÑии ÑиÑÑÐµÐ¼Ñ Ð¿ÑоводиÑÑÑ, как пÑавило, в два ÑÑапа:
1. Ðа ÑеÑÑовом ÑÑапе она позволÑÐµÑ Ð²ÑаÑÑ Ð²Ð¼ÐµÑÑе Ñ Ð¿Ð°ÑиенÑом оÑениÑÑ ÑезÑлÑÑÐ°Ñ Ð¾Ñ ÑеÑапии и понÑÑÑ, Ð¿Ð¾Ð¼Ð¾Ð³Ð°ÐµÑ Ð»Ð¸ ÐµÐ¼Ñ ÑÑÐ¾Ñ Ð¼ÐµÑод. ТеÑÑÐ¾Ð²Ð°Ñ Ð¸Ð¼Ð¿Ð»Ð°Ð½ÑаÑÐ¸Ñ â ÑÑо опеÑаÑÐ¸Ñ Ð¿Ð¾Ð´ меÑÑной анеÑÑезией, когда нейÑÐ¾Ñ Ð¸ÑÑÑг, ÑпиналÑнÑй Ñ Ð¸ÑÑÑг или анеÑÑезиолог ÑеÑез Ð¸Ð³Ð»Ñ Ð¢ÑÐ¾Ñ Ð¸ ÑÑÑÐ°Ð½Ð°Ð²Ð»Ð¸Ð²Ð°ÐµÑ ÑпеÑиалÑнÑй ÑеÑÑовÑй ÑлекÑÑод на ÑооÑвеÑÑÑвÑÑÑий позвоноÑнÑй ÑÑовенÑ, ÑÑководÑÑвÑÑÑÑ ÑомаÑоÑопиÑеÑкой каÑÑой. ÐÑи ÑиндÑоме опеÑиÑованного позвоноÑника, как пÑавило, ÑÑо ÑÑÐ¾Ð²ÐµÐ½Ñ Th11-L1. Ðалее ÑлекÑÑод подклÑÑаеÑÑÑ Ðº внеÑÐ½ÐµÐ¼Ñ ÑÑÑÑойÑÑвÑ, и невÑолог или клиниÑеÑкий Ð¸Ð½Ð¶ÐµÐ½ÐµÑ ÐºÐ¾Ð¼Ð¿Ð°Ð½Ð¸Ð¸-пÑоизводиÑÐµÐ»Ñ Ð½Ð°ÑÐ¸Ð½Ð°ÐµÑ ÑÑимÑлÑÑиÑ, пÑовеÑÑÑ, покÑÑÐ²Ð°ÐµÑ Ð» ÑÑимÑлÑÑÐ¸Ñ (паÑеÑÑезии) вÑÑ Ð·Ð¾Ð½Ñ Ð±Ð¾Ð»Ð¸. ÐÑли неÑ, Ñо под конÑÑолем ÑенÑгена Ñ Ð¸ÑÑÑг коÑÑекÑиÑÑÐµÑ Ð»Ð¾ÐºÐ°Ð»Ð¸Ð·Ð°ÑÐ¸Ñ ÐºÐ¾Ð½ÑакÑов ÑлекÑÑода. ТеÑÑовÑй пеÑиод Ð¼Ð¾Ð¶ÐµÑ Ð´Ð»Ð¸ÑÑÑÑ Ð¾Ñ 2â3 до 7 дней. Ð ÑÑо вÑÐµÐ¼Ñ Ð¿Ð°ÑÐ¸ÐµÐ½Ñ Ð¸ вÑÐ°Ñ Ð¿ÑинимаÑÑ ÑеÑение, ÑÑÑанавливаÑÑ Ð»Ð¸ поÑÑоÑннÑÑ ÑиÑÑемÑ;
2. ÐмпланÑаÑÐ¸Ñ Ð¿Ð¾ÑÑоÑнной ÑиÑÑемÑ, когда Ñ
иÑÑÑг вÑбиÑаеÑ, какой ÑлекÑÑод лÑÑÑе ÑÑÑановиÑÑ Ð¿Ð°ÑиенÑÑ. ÐÑо завиÑÐ¸Ñ Ð¾Ñ Ñ
аÑакÑеÑа боли: пÑи более комплекÑной можно ÑÑÑановиÑÑ ÑлекÑÑод Ñ Ð±Ð¾Ð»ÑÑим колиÑеÑÑвом конÑакÑов, пÑи болÑÑ
более ÑоÑеÑной локализаÑии можно Ñнова по игле импланÑиÑоваÑÑ ÑилиндÑиÑеÑкий ÑлекÑÑод, далее ÑÑннелиÑоваÑÑ ÐµÐ³Ð¾ к генеÑаÑоÑÑ Ð¸Ð¼Ð¿ÑлÑÑов.
СовÑеменнÑе модели генеÑаÑоÑов ÑовÑем не замеÑÐ½Ñ Ð¿Ð¾Ð´ одеждой. РпÑимеÑÑ, ÑамÑй маленÑкий ÑÑимÑлÑÑÐ¾Ñ â вÑего 10 мм в ÑолÑÐ¸Ð½Ñ (Eonminiâ¢ Ð¾Ñ St. Jude Medical Inc.).

РиÑ. 4. ÐÑогÑаммаÑÐ¾Ñ Ð²ÑаÑа â компÑÑÑеÑ, на коÑоÑом вÑÐ°Ñ Ð·Ð°Ð´Ð°ÑÑ Ð²Ñе паÑамеÑÑÑ ÑÑимÑлÑÑии: ÑаÑÑоÑÑ, ÑиÑÐ¸Ð½Ñ Ð¸Ð¼Ð¿ÑлÑÑа, ÑÐ°Ð·Ð¼ÐµÑ Ñага и ÑеÑапевÑиÑеÑкое окно инÑенÑивноÑÑи ÑÑимÑлÑÑии
РоÑновнÑм пÑеимÑÑеÑÑвам нейÑомодÑлÑÑии можно оÑнеÑÑи:
- нейÑоÑÑимÑлÑÑÐ¸Ñ â ÑÑо минималÑно инвазивнÑй ÑовÑеменнÑй меÑод леÑÐµÐ½Ð¸Ñ Ñ ÑониÑеÑÐºÐ¸Ñ Ð±Ð¾Ð»ÐµÐ¹ в Ñпине;
- оÑÑÑÑÑÑвие деÑÑÑÑкÑии неÑвной Ñкани;
- Ð¿Ð¾Ð»Ð½Ð°Ñ Ð¾Ð±ÑаÑимоÑÑÑ ÑÑÑекÑа;
- коÑÑекÑÐ¸Ñ Ð»ÐµÑÐµÐ½Ð¸Ñ Ð½ÐµÐ¸Ð½Ð²Ð°Ð·Ð¸Ð²Ð½Ð° (к инвазивной коÑÑекÑии можно оÑнеÑÑи изменение положениÑ
