Миеломаляция шейного отдела позвоночника
Миелома позвоночника – это не совсем верный термин. Есть такое заболевание, которое называется миеломная болезнь. Она развивается в результате злокачественного перерождения предшественников лимфоцитов. В результате образуется клон злокачественных клеток, который постепенно распространяется по всему организму, поражая костный мозг и внутренние органы.
Поражение позвоночника при миеломе может быть представлено двумя вариантами:
- Единичный очаг остеодеструкции. В этом случае речь идет о солитарной плазмоцитоме.
- Множественные очаги остеодеструкции. Картина соответствует множественной миеломе.
Ряд авторов считает солитарную плазмоцитому ранней стадией развития множественной миеломы, поскольку у большинства больных она со временем диссеминирует по всему организму даже на фоне, казалось бы, радикального излечения.
Поражение костей при миеломе – это неизбежный процесс, который на поздних стадиях заболевания сопровождает каждого больного. При этом отмечаются следующие признаки:
- Остеолизис – расплавление костной ткани.
- Остеопороз – снижение плотности костной ткани.
- На фоне остеолизиса и остеопороза неизбежно возникают патологические переломы – нарушение целостности кости без воздействия выраженного травмирующего фактора.
- Гиперкальциемия – увеличение содержания ионов кальция в крови за счет его выхода из костной ткани.
Причины заболевания
Миелома развивается из-за злокачественного перерождения В-лимфоцитов, точнее их предшественников. Что вызывает эти мутации, не ясно, но есть некоторые закономерности, на фоне которых вероятность развития заболевания увеличивается по сравнению с общей популяцией людей. Эти закономерности называют факторами риска. Для миеломы это:
- Возраст старше 40 лет.
- Мужской пол.
- Негроидная раса.
- Наличие иммунодефицитных состояний, причем как врожденных, так и приобретенных: ВИЧ, лечение цитостатиками, необходимость приема иммуносупрессивной терапии при трансплантации органов и др.
- Наличие миеломы у близких родственников.
- Воздействие радиации, в том числе и лучевая терапия при лечении онкологии.
- Моноклональная гаммапатия.
Механизм прогрессирования заболевания
Механизмы прогрессирования солитарной плазмоцитомы во множественную миелому до конца не изучены ввиду редкости данной патологии. Тем не менее, есть основания полагать что трансформацию вызывает нестабильность генома, когда случайные генетические поломки приводят к тому, что нарушается процесс дифференцировки плазматических клеток, блокируется механизм апоптоза и они начинают бесконтрольно делится и размножаться.

Ранние признаки миеломы позвоночника
На ранних этапах поражения позвоночника симптомы могут отсутствовать, и заболевание обнаруживается случайно, при обследовании по другому поводу. Первым признаком являются боли. Сначала они не интенсивны и не постоянны. Чаще всего, локализуются в области поясницы и грудного отдела. Симптоматика имеет неспецифический характер, поэтому больным часто выставляют неверный диагноз, типа остеохондроза, радикулитов или невралгии.
По мере прогрессирования заболевания, усиливается разрушение костной ткани, что приводит к нарастанию симптоматики. Боли в позвоночнике становятся постоянными, усиливаются от малейшего движения. В некоторых случаях миелома манифестирует с внезапной острой боли, которая возникает из-за патологических переломов. В ряде случаев последние осложняются компрессионным сдавлением спинного мозга и его корешков.
В целом интенсивность болей находится в прямой зависимости от опухолевой массы. Чем больше злокачественных клеток, тем сильнее деструкция костной ткани, соответственно более ярче выражены симптомы.
Неврологические симптомы
При очаговой миеломе неврологическая симптоматика в основном развивается на фоне сдавления опухолевой массой нервных корешков и спинного мозга. При этом будут наблюдаться парезы и параличи, в зависимости от уровня поражения. Второй причиной развития неврологических симптомов являются патологические переломы позвонков.
При трансформации во множественную миелому, неврологические осложнения обнаруживаются у 10-40% больных. Они связаны как с неопластическим действием опухоли на нервные ткани, так и с побочным влиянием химиотерапии, применяющейся для специфического лечения. При этом может поражаться как центральная, так и периферическая нервная система:
- Вегетативная дисфункция – головокружение, быстрая утомляемость, тошнота, тахикардия, нарушения сна и др.
- Пирамидальная недостаточность – нарушается деятельность мышц, снижается их двигательная активность и тонус, постепенно это приводит к атрофическим изменениям. Могут быть клонические судороги.
- Мозжечковая недостаточность – нарушение координации движения, выраженное в виде непроизвольных мышечных сокращений (хорея, миоклонии), нарушение мимики, речи и интеллекта, тремор головы и конечностей.
Миеломаляция
Под действием опухолевых клеток, в ткани кости возникают очаги деструкции. Во-первых, это связано с непосредственным замещением костной ткани опухолью. Во-вторых, злокачественные клетки выделяют вещества, которые подавляют деятельность остеобластов (клеток, отвечающих за репарацию костного вещества) и активируют действия остеокластов, которые наоборот, приводят к разрушению кости за счет растворения ее минеральной составляющей.
Диагностика
Для постановки диагноза необходимо проведение комплексного обследования, включающего ряд инструментальных исследований.
Анализ крови и мочи
В общем анализе крови часто обнаруживается нормохромная, реже – макроцитарная анемия. Характерным признаком является увеличение СОЭ, у некоторых пациентов оно может превышать 100 мм/час. При обширном поражении костного мозга выявляется нейтропения и тромбоцитопения.
В общем анализе мочи обнаруживается нарастающая протеинурия, которая связана с прогрессированием нефропатии. При специальных исследованиях обнаруживается специфический белок – М-белок, М-градиент, белок Бенс-Джонса.
Миелограмма
В миелограмме (изучение образца костного мозга под микроскопом) обнаруживается увеличение содержания плазматических клеток. Диагноз миелома выставляется, если количество плазмоцитов превышает 10%.
Рентгенография и МРТ
Рентгенологические методы диагностики не являются специфичными, но они позволяют определить стадию и степень распространения миеломы. При солитарной плазмоцитоме будет обнаруживается единичный очаг остеолизиса. При множественной миеломе на снимках будет обнаруживаться остеопения и множественные очаги остеолизиса. Характерной картиной является обнаружение на снимках большого количества «штампованных» очагов деструкции, которые выглядят как зоны рентгенологического просветления. Для диагностики используется рентген позвоночника в 2-х проекциях, при малой информативности назначается компьютерная томография. ПЭТ-КТ позволит обнаружить микроочаги опухолевого поражения, которые не визуализируются другими методами исследования. Для оценки повреждения спинного мозга и спинномозговых корешков при патологических переломах позвоночников может назначаться МРТ.
Лечение
Лучевая терапия
Большинство больных с миеломой позвоночника проходят лечение с помощью лучевой терапии в суммарной дозе 40 Гр, поскольку миеломные клетки очень чувствительны к ионизирующему излучению. При размере опухоли более 5 см, дозу могут увеличить до 50Гр. Поле облучения должно включать минимум по одному непораженному позвонку сверху и снизу от места локализации опухоли. Признаками эффективности лечения является склероз и реминерализация очага поражения.
При лечении множественной миеломы с поражением позвоночника, облучение применяется в рамках паллиативной терапии для облегчения болевого синдрома и замедления остеолизиса.
Хирургическое лечение
Хирургическое лечение показано пациентам с функциональной нестабильностью позвоночника и при наличии неврологической симптоматики. В ряде случаев, при наличии показаний, пациенту предлагают провести операцию превентивно, не дожидаясь патологических переломов. В рамках лечения применяются различные виды вертебропластики.
Химиотерапия
Применение химиотерапии для пациентов с солитарной плазмоцитомой остается спорным моментом. А вот для пациентов с множественной миеломой с поражением позвоночника, это ключевой метод лечения. Большие успехи были достигнуты при включении в протоколы талидомида, леналидомида и бортезомиба:
- Бортезомиб – ингибитор протеасом – ферментов, которые играют важную роль в поддержании гомеостаза клетки, ее росте и размножении. Подавление действия протеасом блокирует селективный протеолиз, что влияет на многие внутриклеточные процессы, в том числе на передачу сигналов. Все вместе это приводит к гибели клетки. Помимо этого, экспериментально было подтверждено, что бортезомиб усиливает активность остеобластов и подавляет функции остеокластов у больных с миеломой.
- Талидомид – препарат, оказывающий иммуномодулирующее, антиангиогенное и цитотоксическое действие. Предпосылкой к применению данного препарата послужили данные о том, что у больных с миеломой в костном мозге обнаруживается усиление ангиогенеза, что способствует пролиферации и рассеиванию злокачественных клеток. При дальнейших испытаниях было выявлено, что помимо антиангиогенного действия, препарат вызывает клеточный апоптоз. В настоящее время талидомид применяется у больных, лечение которым еще не назначалось, при рецидивах после предыдущих курсов химиотерапии, а также у больных, резистентных к другим видами препаратов. Может применяться как в качестве монотерапии, так и в схемах полихимиотерапии.
- Леналидомид. С точки зрения структуры, аналогичен талидомиду, но оказывает более выраженное биологическое действие. Наибольшую эффективность показал при терапии гемопоэтических опухолей, особенно при наличии мутаций 5 хромосомы.
Пациенты с костными миеломами, в том числе с миеломой позвоночника являются сложной категорией больных, сложно поддающихся терапии. Поэтому им по возможности назначаются 4-5 компонентные схемы химиотерапии, например, VDCR или VD-PACE, которые имеют в своем составе бортезомиб.
Дает ли миелома позвоночника метастазы?
К сожалению, все имеющиеся на сегодняшний день методы терапии солитарной плазмоцитомы не гарантируют полного излечения. Могут развиваться рецидивы, которые локализуются как вне пределов первичной опухоли, так и на месте бывшего очага. Реже поражаются регионарные лимфатические узлы.
Также очаговая миелома (плазмоцитома) может трансформироваться в миеломную болезнь. У половины больных, трансформация обнаруживается в течении 5 лет после лечения плазмоцитомы, и у 72% – в течение 10 лет. Среднее время до прогрессирования составляет 2 года, но могут быть существенные различия. Ключевым моментом является возраст больного – чем он старше, тем выше риск трансформации.
Прогноз выживаемости
При хороших результатах лечения первичной опухоли и отсутствии трансформации в множественную миелому, прогнозы относительно неплохие. Общая пятилетняя выживаемость таких больных составляет 74%, 10-летняя 34-54%. Главным фактором, влияющим на выживаемость, является возраст больного. Для пациентов младше 60 лет, прогноз более благоприятный.
Осложнения
Основными осложнениями миеломы позвоночника являются компрессионные переломы со сдавлением спинного мозга и спинномозговых корешков. При этом развиваются выраженные боли, парезы и параличи. Для устранения таких осложнений применяются реконструктивные хирургические вмешательства.
Ремиссия
О достижении ремиссии свидетельствует склероз и реминерализация опухолевого очага. Все пациенты, прошедшие лечение по поводу очаговой плазмоцитомы, должны находиться под пожизненным медицинским наблюдением, поскольку всегда сохраняется вероятность прогрессирования заболевания во множественную миелому.
Источник
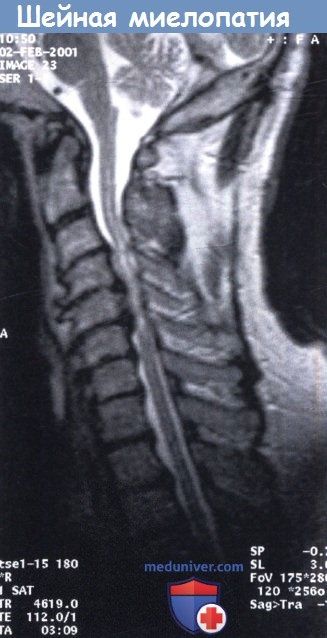
Шейная миелопатия – методы диагностики, лечения по Европейским рекомендацияма) Определение. Шейная спондилотическая миелопатия – хорошо описанный клинический синдром, который может быть вызван различными механизмами (травматическими, дегенеративными, опухолевыми или инфекционными). б) Этиология/эпидемиология шейной миелопатии. Общая концепция о том, что сужение позвоночного канала вызывает компрессию спинного мозга и приводит к ишемии, повреждению и неврологическим нарушениям, в последнее время была поставлена под сомнение. Существует доказательство того, что спондилотическое сужение позвоночного канала и ненормальные или чрезмерные движения в шейном отделе позвоночника приводят к локализованным повреждениям спинного мозга. Клинически значимая шейная миелопатия обычно появляется в пожилом возрасте в условиях нарастающих дегенеративных изменений, что вызывает усиливающееся давление передних и задних структур. Основой этих анатомических изменений являются дегенеративные процессы шейных межпозвоночных дисков, образование остеофитов и грануляций, утолщение желтой связки и гипертрофия фасеток в результате остеоартрита. Пациенты с врожденным стенозом подвергаются более высокому риску по сравнению с пациентами с более широким позвоночным каналом. Таким образом, при диаметре позвоночного канала менее 12 мм в сагиттальной проекции существует прямая связь с развитием миелопатии, а пациенты с диаметром позвоночного канала более 16 мм имеют более низкий риск развития заболевания. в) Симптомы. Признаком шейной миелопатии является поражение длинных трактов! – Ощущения прохождения тока в конечностях, связанные с быстрым сгибанием/разгибанием шеи (симптом Лермитта) – Восходящее онемение в нижних конечностях при разгибании шеи. – Постепенное развитие признаков дисфункции спинного мозга с мышечной спастично-стью, гиперрефлексией, нарушением рефлексов (симптом Бабинского, рефлекс Гоффмана) и клонусы. – Спастический парез в руках и мышцах предплечья – Онемение рук с нарушением мелкой моторики. – Болезненные парестезии. – Слабость нижних конечностей. – Спастическая походка, стойка с широко расставленными ногами. – Атрофия и/или фасцикулляции. – Дисфункция сфинктеров. г) Диагностика шейной миелопатии: • МРТ (следить за изменением сигнала спинного мозга!). • Обычная рентгенография. • КТ с дополнительной двухмерной реконструкцией. д) Лечение шейной миелопатии: • Консервативное лечение: иммобилизация, физиотерапия, лекарственные препараты. • Оперативное лечение: разногласия относительно оптимальных сроков и показаний к хирургическим вмешательствам. Показаниями является прогрессирующая мышечная слабость, нарушения походки, частое мочеиспускание или недержание мочи, потеря координации кистей и нарушение навыков мелкой моторики. Выбор оперативного вмешательства, с ожидаемой наибольшей пользой для пациента, зависит от многих факторов, таких как направление компрессии, очаговое или диффузное/многоуровневое поражение, концентрическая компрессия, наличие или отсутствие нестабильности или деформации. Должны быть рассмотрены минимально инвазивные оперативные процедуры с адекватной декомпрессией спинного мозга. – Передний доступ для декомпрессии: (мы предпочитаем передний доступ при хирургическом лечении миелопатии, особенно, если компрессия связана с нестабильностью или кифотической деформацией). • Передняя дискэктомия и фиксация (на одном или нескольких уровнях) с укреплением пластиной или без, при передней компрессии на уровне межпозвонкового диска. • Передняя шейная корпорэктомия и фиксация с использованием костного аутотрансплантанта или другого материала. Для предотвращения дислокации трансплантата проводится дополнительное усиление пластиной. • Передняя многоуровневая корпорэктомия. – Задний доступ для декомпрессии: • Ламинэктомия (на одном или нескольких уровнях): учитывать риск деформации шеи. Существующий шейный кифоз является противопоказанием для многоуровневой ламинэктомии без последующей фиксации. В таких случаях необходимо прибегать к остеосинтезу и задней фиксации (например, имплантации винтов в латеральные массы с балками). • Ламинопластика: описаны различные методики, но многие являются модификацией техники «открытых дверей». – Комбинированные переднезадние доступы для декомпрессии: • Показаны в случае компрессии с обеих сторон. Эти случаи почти всегда связаны с нестабильностью и поэтому после передней дискэктомии и фиксации выполняется задняя декомпрессия и фиксация. Декомпрессия изначально выполняется на стороне большей компрессии. е) Прогноз. Естественное течение шейной миелопатии вариабельно. Ранние исследования указывали на прогрессирующее ухудшение неврологических симптомов при миелопатии, но сообщалось и о длительном периоде без ухудшения. В большинстве случаев первоначальное ухудшение сменяется длящимся многие годы статическим периодом. Пожилые пациенты с моторным дефицитом более склонны к развитию прогрессирующего ухудшения, а пациенты с более легким течением болезни имеют лучший прогноз. Сравнение хирургического и медикаментозного лечения пациентов с миелопатией выявило, что более благоприятный исход описывается после хирургического лечения. У пациентов с высоким интрамедуллярным изменением сигнала на Т2-взвешенных изображениях без клонусов или спастичности можно ожидать хороший хирургический результат и регресс изменений по данным МРТ, в то время как у пациентов с низким интрамедуллярным сигналом на Т1-взвешенных изображениях с клонусами или спастичностью прогнозируется менее благоприятный исход.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021 – Также рекомендуем “Оссификация задней продольной связки – методы диагностики, лечения по Европейским рекомендациям” Оглавление темы “Нейрохирургия дегенеративных болезней позвоночника.”:
|
Источник
